Ropa se ve vodě konsoliduje, protože to zvyšuje entropii $ S $. Stoupá nahoru, protože to snižuje entalpii $ H $. Když se obě akce stanou společně, sníží to Gibbsovu volnou energii $ G $.
$$ \ Delta G = \ Delta H - T \ Delta S $$
Jak poznamenal DavePhD, mezi páry molekul vody se tvoří vodíkové vazby. Jak komentoval Aaron Stevens v duplicitní otázce, „polární molekuly vody mají více konfigurací, aby vytvářely vodíkové vazby se svými sousedy.“
Zejména pokud jsou v nádobě molekuly vody ve výši $ N $, má daná molekula možné způsoby (termodynamické stavy) $ N $ k vytvoření jedné vodíkové vazby. (Technicky vzato, $ N-1 $, protože molekula se nemůže vázat na sebe, ale u velkého počtu molekul není rozdíl důležitý).
Pokud molekula vody vytvoří dvě vodíkové vazby, nyní existuje $ N ^ 2 $ způsob, jak to udělat. Se třemi vodíkovými vazbami, $ N ^ 3 $ způsoby. Vidíte, že s tím, jak se v nádobě tvoří více vodíkových vazeb, je možné více termodynamických stavů. To zvyšuje entropii.
Vodíkové vazby se netvoří mezi olejem a vodou ani mezi dvěma molekulami oleje. Když je molekula vody obklopena olejem, vytváří méně vodíkových vazeb a celková entropie klesá. Entropie je tedy maximalizována sloučením (shromážděním) oleje do souvislé hmoty, takže voda s ním naváže minimální kontakt.
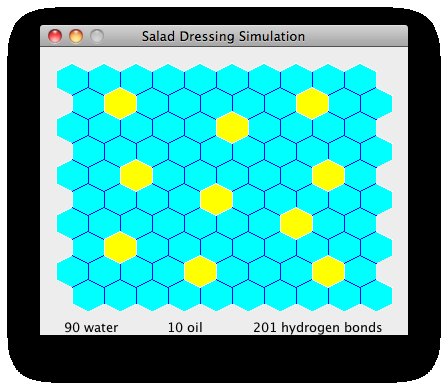
To ilustrují následující obrázky ze simulace, kterou jsem napsal k zodpovězení této otázky. Hexy jsou molekuly, 90 voda (azurová) a 10 olej (žlutá). Hranice mezi molekulami jsou nakresleny modře, pokud tvoří vodíkovou vazbu, a bílou, pokud ne. Celkový počet vodíkových vazeb je zobrazen ve spodní části simulace.
Prohlédněte si obrázek v horní části této odpovědi. Olej je dobře promíchán s vodou a voda tvoří 201 vodíkových vazeb.
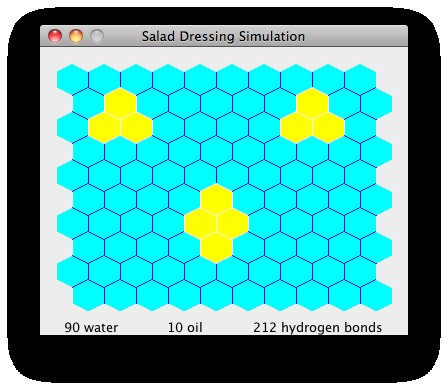
Jak se olej začíná konsolidovat, molekuly vody mohou mezi sebou vytvářet více vodíkových vazeb (nyní 212):
Když je olej plně konsolidovaný, může se vytvořit maximální počet vodíkových vazeb (233):
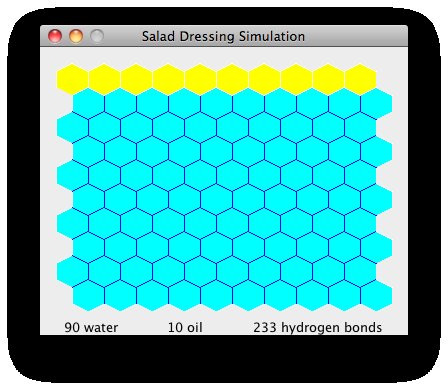
Vidíte, že počet vodíkových vazeb - a tím i entropie - je maximalizován při konsolidaci oleje.
Olej pluje (stoupá nahoru) kvůli entalpii. Konkrétně je potenciální energie směsi kombinovaná gravitační potenciální energie molekul. To je minimalizováno umístěním oleje nad vodu.
Při absenci gravitace se ropa bude konsolidovat, ale nebude plavat. Pokud je však přítomna gravitace, dojde k oběma efektům, aby se minimalizovala Gibbsova volná energie.
Dodatek: „Při absenci gravitace se ropa spojí, ale nebude plavat.“ Experimenty Mezinárodní vesmírné stanice to potvrzují:
Směsi koloidu a polymeru:
Výsledky experimentů ISS studovaly spinodální rozklad nebo fázovou separaci poblíž kritického bodu, nezatížené rozdíly hustoty fází. Růst fázové separace byl studován pomocí rozptylu světla i zobrazování. Bez gravitace trvala fázová separace 30krát déle než na Zemi. Vzorek byl smíchán, poté byla zahájena fázová separace, která postupně zhrubla, dokud stěny nádoby neinteragovaly se směsí (po 42 hodinách) a fáze bohatá na koloidy navlhčila stěnu nádoby a po 60 hodinách ji zcela potáhla.
Kritický bod koloid-polymer: Okamžitě po smíchání se vzorek kritického bodu koloid-polymer začal rozdělovat do dvou fází - jedné, která připomínala plyn, a druhé, která připomínala kapalinu, kromě toho, že částice byly koloidy a ne atomy.Oblasti chudé na koloidy (koloidní? Plynná? Fáze) rostly větší, až nakonec bylo dosaženo úplného oddělení fází a do každé z nich byla jen jedna oblast - fáze bohatá na koloidy a fáze chudá na koloidy.Nic z tohoto chování nelze ve vzorku na Zemi pozorovat, protože sedimentace by způsobila, že koloidy padnou na dno buňky rychleji, než by mohlo dojít k procesu smíchání.Znalosti získané z těchto běhů byly použity k vývoji BCAT-3 později provozovaného na ISS.
EXPRESNÍ Fyzika koloidů ve vesmíru